高考化学复习资料:氧化还原反应知识点整理
一、概念判断:
1、氧化还原反应的实质:有电子的转移(得失)
2、氧化还原反应的特征:有化合价的升降(判断是否氧化还原反应)
3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),
也可能被还原(由阴离子变单质)。
8、元素最高价态有氧化性,但不一定有强氧化性;元素最低价态有还原性,但不一定有强还原性;阳离子不一定只有氧化性(不一定是最高价态,,如:Fe2+),阴离子不一定只有还原性(不一定是最低价态,如:SO32-)。
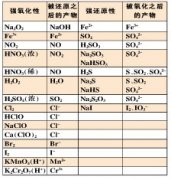
9、常见的氧化剂和还原剂:
10、氧化还原反应与四大反应类型的关系:
置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合反应和分解反应中有一部分是氧化还原反应。
例、在H+、Fe2+、Fe3+、S2-、S中,只有氧化性的是________________,只有还原性的是________________,既有氧化性又有还原性的是___________。
二、氧化还原反应的表示:(用双、单线桥表示氧化还原反应的电子转移情况)
1、双线桥:“谁”变“谁”(还原剂变成氧化产物,氧化剂变成还原产物)
例:
2、单线桥:“谁”给“谁”(还原剂将电子转移给氧化剂)
例:
三、氧化还原反应的分析
1、氧化还原反应的类型:
(1)置换反应(一定是氧化还原反应)
2CuO + C = 2Cu + CO2 SiO2+2C =Si + 2CO
2Mg + CO2 = 2MgO + C 2Al+ Fe2O3= 2Fe + Al2O3
2Na+2H2O= 2NaOH+ H2↑ 2Al+6H+= 2Al3++3 H2↑
2Br -+ Cl2= Br2+2Cl– Fe+ Cu2+ = Fe2++ Cu
(2)化合反应(一部分是氧化还原反应)
2CO+ O2 = 2CO2 3Mg + N2 = Mg3N2
2SO2+ O2 = 2SO3 2FeCl2+ Cl2 = 2FeCl3
(3)分解反应(一部分是氧化还原反应)
4HNO3(浓)= 4NO2↑+ O2↑+ 2H2O 2HClO = 2HCl + O2↑
2KClO3= 2KCl + 3O2↑
(4)部分氧化还原反应:
MnO2+4 HCl(浓)= MnCl2+ Cl 2↑+2 H2O
Cu + 4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O
3Cu + 8HNO3= 3Cu(NO3)2+2NO↑+4H2O
Cu+ 2H2SO4(浓)=CuSO4+SO2↑+ 2H2O
(5)自身氧化还原反应:(歧化反应)
Cl 2+ H2O = HCl + HClO 3S+ 6OH-= 2S2-+ SO32-+3H2O
2Na2O2+2H2O=4NaOH+ O2↑; 2Na2O2+2CO2=2Na2CO3+ O2
2Ca(OH)2+ 2Cl 2= CaCl2+ Ca(ClO)2+ 2H2O
(6)同种元素不同价态之间的氧化还原反应(归中反应)
2H2S + SO2= 3S + 3H2O
5Cl –+ ClO3-+6H+=3Cl2↑ + 3H2O
(7)氧化剂、还原剂、氧化产物、还原产物不止一种的氧化还原反应:
2KNO3+ S + 3C = K2S + N2↑ +3CO2↑
2KMnO4= K2MnO4+ MnO2+ O2↑
2、氧化还原反应分析:
(1)找四物:氧化剂、还原剂、氧化产物、还原产物
(2)分析四物中亮的关系:特别是歧化反应、归中反应、部分氧化还原反应
(3)电子转移的量与反应物或产物的关系
例:根据反应:8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)氧化剂是_______,还原剂是______,氧化剂与还原剂的物质的量比是____________;
(2)当有68gNH3参加反应时,被氧化物质的质量是____________g,生成的还原产物的物质的量是____________mol。
四、氧化性、还原性的判断
例:根据下列反应:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+。判断离子的还原性由强到弱的是
A.Br->Fe2+>I- B.I->Fe2+>Br- C.Br->I->Fe2+ D.Fe2+>I->Br-
五、电子转移守恒的应用
在氧化还原反应中,还原剂失去的电子总数等于氧化剂得电子总数。
例:用0.1mol·L-1Na2SO3溶液30mL,恰好将2×10-3mol的XO4-离子还原,则元素X在还原产物中的化合价是 ( )
A、+1 B、+2 C、+3 D、+4
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教